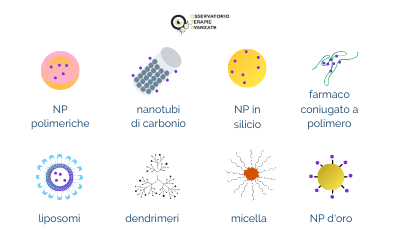
Liposomi, nanoparticelle polimeriche, supermagnetiche o d’oro, dendrimeri… Sono tante le metodiche innovative in sperimentazione per il trasporto dei farmaci nelle cellule bersaglio
Le nanotecnologie si occupano della scienza delle cosiddette nanostrutture, cioè degli oggetti prodotti a partire da una moltitudine di materiali e con dimensioni dell’ordine del miliardesimo di metro (nanometro). È un settore in piena espansione e le applicazioni sono molteplici, andando dall’elettronica alla fisica dei materiali, dalla farmacologia ai catalizzatori industriali, dagli pneumatici ultraresistenti ai pigmenti per la stampa. In ambito biomedico ci sono numerose nanostrutture in studio per rilascio di farmaci, protesi, sensori, ingegneria tissutale e genomica. In questo approfondimento, Osservatorio Terapie Avanzate descrive le tipologie di nanoparticelle usate come metodo innovativo di trasporto e “delivery” (consegna) dei farmaci.
Negli ultimi decenni, i progressi nelle tecniche di somministrazione dei farmaci sono stati un fattore fondamentale per l’approvazione di nuove terapie. La collaborazione tra diversi specialisti - biologi, chimici, ingegneri, fisici - ha supportato lo sviluppo di nanomateriali e nanostrutture innovative. Uno degli ambiti di ricerca più floridi è la nanomedicina, in cui le tecniche di trasporto e consegna dei farmaci trovano il loro spazio. Ampliare la disponibilità di sistemi di trasporto, infatti, potrebbe aumentare il numero di molecole utilizzabili dato che spesso non possono essere sperimentate – o usate efficacemente - a causa di problemi collegati alla loro metabolizzazione da parte della cellula.
Grande interesse e grandi timori: pur avendo ottenuto buoni risultati in laboratorio, il rischio collegato al rilascio a lungo termine di oggetti microscopici non è ancora noto, né sull’ecosistema in generale né sulla salute umana. Inoltre, aumentare le conoscenze e i dati a disposizione sulle opzioni di trasporto di acidi nucleici (DNA e RNA) nelle cellule potrebbe essere utile anche per la terapia genica, in cui attualmente si utilizzano quasi esclusivamente vettori virali. Questi ultimi, infatti, hanno alcune limitazioni per quanto riguarda il carico da trasportare ed effetti collaterale, tra cui l’immunogenicità. Recentemente sono stati pubblicati degli articoli sui rischi collegati all’utilizzo di alte dosi di vettori virali per la terapia genica. Il riconoscimento del capside virali da parte degli anticorpi dell’organismo può portare ad una risposta immunitaria letale (ne abbiamo parlato qui). Anche per CRISPR si studiano metodi alternativi di trasporto, perché l’efficienza di trasferimento è uno dei suoi punti deboli: non solo virus, ma anche campi elettrici, nanomateriali e luce. Sul tema “editing genomico e trasporto” è stato pubblicato a giugno un approfondimento su Nature Biotechnology.
Tornando alle nanotecnologie, forma e dimensioni - oltre alle caratteristiche intrinseche del materiale - sono importantissime in questo ambito perchè hanno un ruolo fondamentale nei processi di degradazione, dinamica vascolare, targeting. Le nanoparticelle per il trasporto dei farmaci si suddividono in organiche e inorganiche, a seconda del tipo di materiale utilizzato, e sono classificate in base alla tipologia di bersaglio (“targeting”), che può essere attivo o passivo. In commercio ci sono già farmaci basati su modalità di consegna innovative, ad esempio per i tumori, la meningite, l’epatite C e le infezioni.
ORGANICHE
Liposomi (da 50 nanometri ad alcuni micrometri). Sono vescicole artificiali assemblate a partire da fosfolipidi per formare una struttura sferica a doppio strato che circonda una piccola area acquosa. I fosfolipidi sono molecole costituite da una testa idrofila e una coda idrofoba e in soluzione acquosa si dispongono spontaneamente in un doppio strato con le code all’interno e, se stimolati opportunamente, possono formare una sfera stabile contenente una piccola parte del liquido in cui vengono immersi. Hanno una buona biocompatibilità e biodegradabilità e isolano efficacemente il farmaco al loro interno. Purtroppo, hanno una bassa efficienza di incapsulamento, il rilascio del “carico” è rapido e la loro conservazione non è ottimale. Restano comunque i sistemi più consolidati a livello clinico per la somministrazione di farmaci, con già alcune applicazioni. Un esempio è l’antitumorale doxorubicina liposomale, che in questa preparazione ha minor effetti collaterali e miglior tempo di circolazione nel sangue.
Nanoparticelle polimeriche (dai 10 ai 100 nanometri). Si tratta di particelle colloidali prodotte con polimeri sintetici biodegradabili (ad esempio i poliacrilati) o con polimeri naturali (come alginato, albumina, collagene) e possono essere di forme diverse. Ne sono state sviluppate anche versioni “intelligenti”, in grado di cambiare le proprietà chimico-fisiche in base agli stimoli esterni.
Un gruppo di ricerca di Basilea (Svizzera) ha trovato il modo di far entrare dei piccoli container artificiali nel nucleo delle cellule viventi. I polimersomi (circa 60 nm) sono vescicole polimeriche biocompatibili in grado di attraversare la membrana e trasportare i farmaci direttamente al nucleo. Possibili applicazioni riguardano i chemioterapici e la terapia genica. Per ora è stata sperimentata la loro capacità di spostamento e consegna utilizzando dei coloranti, ma il prossimo passo prevede agenti terapeutici. In generale, i polimersomi possono trasportare efficacemente molecole integre e attive, con bassa tossicità per la cellula - proteine, anticorpi, antigeni, acidi nucleici, fattori di trascrizione, enzimi per l’editing genomico - ma hanno alcuni limiti che riguardano l’assorbimento e il metabolismo.
I ricercatori della John Hopkins hanno recentemente creato delle nanoparticelle biodegradabili in grado di fornire, in modello murino, un “gene del suicidio” alle cellule tumorali del cervello umano. Queste particelle vengono iniettate nella massa tumorale, dove vengono inglobate dalle cellule e poi rilasciano il carico. Le nanoparticelle possono trasportare geni molto più grandi rispetto ai vettori virali tradizionalmente utilizzati nella terapia genica. Inoltre, sono più facili da manipolare e hanno bassa immunogenicità.
Micelle polimeriche (da 10 a 100 nanometri). Si formano quando molecole polimeriche si associano spontaneamente in un ambiente acquoso. Il loro nucleo resta idrofobico ed è compatibile con i farmaci poco solubili. Utilizzando tecniche di simulazione al computer, la preparazione sperimentale di queste nanoparticelle potrebbe essere guidata in modo più efficiente.
Nanoparticelle di idrogel (inferiore a 100 nanometri). L’idrogel è un materiale molto studiato – anche nell’ingegneria tissutale - perché, per le sue caratteristiche, è in grado di mimare le funzioni biologiche dei tessuti dell’organismo umano. È formato da una rete di polimeri idrofili che possono assorbire e trattenere più del 20% del loro peso in acqua, mantenendo la struttura. Le proprietà, tra cui la struttura e la permeabilità, possono essere regolate da stimoli esterni. Queste strutture sono studiate per il rilascio controllato del farmaco, il rilascio in risposta a uno stimolo e la loro applicazione in impianti biologici. Sebbene siano molto buoni per quanto riguarda la biocompatibilità e l’efficacia nel caricamento dei farmaci, la loro risposta è abbastanza lenta e, di conseguenza, si stanno studiando idrogel ibridi per migliorare il sistema.
Farmaco coniugato a polimero (anche più di 100 nanometri). I farmaci idrofobici sono altamente attivi e ampiamente utilizzati in una varietà di terapie tumorali, a questi composti sono però associati reazioni di ipersensibilità ed effetti collaterali. Per ridurre la tossicità sono state create delle nanoparticelle coniugate a proteine, ad esempio albumina e farmaco antitumorale. Un esempio è il chemioterapico paclitaxel per il cancro al seno metastatico.
Dendrimeri (da 1 a 10 nanometri). Sono macromolecole che formano una struttura ad albero ben definita e radialmente simmetrica e omogenea. Possono essere controllati con precisione sia il peso che la composizione: pur essendo piccoli, le loro ramificazioni permettono il carico di farmaci sulla superficie (non incapsulati). I dendrimeri sono chimicamente stabili, hanno bassa citotossicità e solubilità. Una delle loro applicazioni più promettenti è proprio il trasporto di farmaci, specialmente chemioterapici.
Vescicole extracellulari (dai 20 ai 5000 nanometri, a seconda della tipologia). Restando in ambito organico, ci sono anche studi sulle possibilità di utilizzo delle vescicole extracellulari (esosomi, microvescicole, corpi apoptotici) in ambito terapeutico, sia come mezzo di trasporto per acidi nucleici e proteine sia come fonte di fattori immunoregolatori. Si tratta di vescicole microscopiche prodotte dalle cellule stesse implicate nella comunicazione intercellulare e inter-organismica, sia nei processi cellulari normali che patologici. Gli studi sono in fase preclinica e le applicazioni limitate, ma è un altro settore da monitorare per il futuro delle “consegne” a livello cellulare.
INORGANICHE
Nanoparticelle d’oro (da 1 a 100 nanometri). Sono già usate e sono utili per la consegna di farmaci “classici” e anche di geni. La tossicità è bassa e la sintesi facile, rendendoli una valida opzione. Le nanoparticelle d’oro hanno un’ampia superficie di rilascio e le forme più utilizzate sono la sfera e i nanorodi. Vengono utilizzate in molti ambiti della biomedicina grazie alle loro proprietà ottiche, chimico-fisiche ed elettriche che possono essere modificate in base alla forma e alle dimensioni della nanoparticella, ma anche dall’ambiente circostante.
Superparamagnetiche (dai 10 ai 180 nanometri). Le proprietà superparamagnetiche delle particelle di ossido di ferro (SPIONs) possono essere utilizzate per guidare le nanoparticelle nel trasporto dei farmaci e il rilascio può essere regolato cambiando fattori come la temperatura. Hanno alcuni vantaggi: minima invasività, maggiore accessibilità e pochi effetti collaterali. Oltre al trasporto di farmaci, le nanoparticelle supermagnetiche vengono utilizzate in vivo e in vitro anche per il trattamento dell’ipertermia, il trasporto di geni e la radioterapia.
Nanoparticelle di ceramica (da 20 a 100 nanometri). Sono particelle fabbricate con composti inorganici dalle caratteristiche porose, come la silice, che formano canali interni e una trama a nido d’ape. Le nanoparticelle in silice hanno attirato l’attenzione per la loro biocompatibilià e facilità di sintesi. La loro superficie può essere ingegnerizzata con molecole organiche, proteine, anticorpi, etc. e possono essere preparate in modo diverso per adattarsi alle caratteristiche del carico. Le applicazioni in vitro hanno dato buoni risultati ma, non essendo biodegradabili, sono in corso studi sul rischio di accumulo nell’organismo.
Nanomateriali a base di carbonio. Molto studiati sono i nanotubi di carbonio (diametro da 2.5 a 100 nanometri) e i nanodiamanti (da 2 a 9 nanometri): possono essere ingegnerizzati grazie all’innesto di altre molecole (acidi nucleici, proteine, anticorpi, etc.) sulla superficie. Lo svantaggio principale è la tossicità a livello cellulare, dato che possono inibire la proliferazione cellulare o indurne la morte. Proprio per questo, le sperimentazioni a livello biomedico sono poche.
TARGETING ATTIVO E PASSIVO
Il targeting passivo si basa sulle caratteristiche uniche del bersaglio (ad esempio l’ambiente tumorale e i suoi vasi), permettendo ai nanofarmaci di accumularsi nel sito corretto. Essere circondato da cellule sane aiuta il targeting. Ci sono diversi limiti perché è difficile raggiungere la zona interna del tumore e controllare il processo. Inoltre, alcune caratteristiche possono variare, creando qualche problema. I limiti del targeting passivo possono essere superati coniugando delle molecole al vettore, in grado di riconoscere specifici recettori cellulari. Per avere l’effetto desiderato, questi recettori devono essere presenti solo sulla superficie delle cellule target del farmaco.
UN FUTURO ALL’AVANGUARDIA
Le nanotecnologie applicate al trasporto di farmaci non si limitano a questo elenco: le sperimentazioni in corso sono molte e vedono progetti interessanti, a volte al limite della fantascienza. Un esempio sono i microrobot creati coniugando il batterio Escherichia coli con nanoeritrosomi, ovvero un batterio con delle microscopiche strutture derivate dai globuli rossi - che vengono svuotati e rimpiccioliti - “appiccicate” chimicamente sulla sua superficie. L’E. coli permette lo spostamento e i nanoeritrosomi sono i vettori. Sempre parlando di globuli rossi, un gruppo della McMaster University (Canada) ha sviluppato un processo per modificarli e renderli dei trasportatori di farmaci. In poche parole, il globulo rosso viene svuotato, caricato con il farmaco, e modificato superficialmente in modo da attaccare le giuste cellule (ad esempio attaccandosi ai batteri e rilasciando un antibiotico).
L’idea di sfruttare i globuli rossi per veicolare farmaci è stata messa in pratica anche da una startup italiana: EryDel. Il prodotto in fase di sviluppo più avanzata è EryDex, come trattamento per l’atassia telangectasia (AT) ora in sperimentazione in uno studio multicentrico di Fase III. La terapia si basa sull’incapsulamento di un farmaco steroideo nei globuli rossi che permette il suo graduale rilascio nella circolazione del paziente. Lo studio valuterà l'efficacia e la sicurezza di questo approccio nel trattamento dei sintomi neurologici causati dall’AT.
Alcuni ricercatori sono arrivati a studiare le tossine come possibile mezzo di trasporto per i farmaci perché uno dei problemi principali nell’inserire qualcosa nelle cellule è che viene distrutta appena entra nella cellula. La tossina difterica, al contrario, non viene distrutta: dal punto di vista biologico riesce a scappare dai sistemi di controllo della cellula e ucciderla. Se modificata e resa non tossica, può essere una opzione come sistema di trasporto di farmaci, come è stato tentato con terapie su RNA contro il glioblastoma.
La complessità dell’organismo umano e delle malattie che lo colpiscono sono una sfida continua per chi studia e sviluppa nuovi farmaci. È praticamente impossibile trovare un farmaco utile, sicuro, che colpisce solo il bersaglio prefissato, con una durata d’azione giusta, senza effetti collaterali e con un profilo farmacocinetico perfetto. I sistemi di trasporto e consegna offrono la possibilità di portare ad un livello più alto la farmacologia: per ora studi e brevetti sono diversi, ma le applicazioni poche. Inoltre, il loro sviluppo è molto costoso. Per quanto riguarda il regolatorio, ci sono alcuni documenti a disposizione dei produttori di nanofarmaci sul sito della European Medicine Agency, ma è ancora un settore in piena evoluzione, anche sul fronte della gestione burocratica.