Un rivoluzionario sistema di stampa favorisce il passaggio di ossigeno e nutrienti anche in modelli d’organo complessi come polmone e fegato
Che la stampa 3D potesse calcare il palcoscenico della medicina rigenerativa era chiaro agli occhi di tutti ma che potesse giungere ad ottenere in tempi così rapidi una parte da protagonista non era esattamente scontato. Quello che, fino a pochi anni fa, poteva dare l’impressione di essere un hobby ingegneristico o un giochetto da nerd, è diventato un sofisticato strumento di ricerca dalle enormi potenzialità al quale i ricercatori di tutto il mondo guardano con profondo interesse. Una solida testimonianza di questo cambiamento di rotta proviene dai risultati di una ricerca israeliana che ha portato alla stampa 3D di un cuore a partire dalle cellule staminali del paziente.
Di certo il perfezionamento delle tecniche di stampa ha contribuito in maniera determinante a questo balzo in avanti, ma l’elemento che principalmente ha trasformato la stampa 3D in un’autentica fornace di organi è dato dai nuovissimi bioinchiostri usati per ricreare i tessuti usando le cellule staminali degli stessi pazienti. Risultato? Nessun rischio di rigetto d’organo e, di conseguenza, nessun bisogno di sottoporre i pazienti a terapia immunosoppressiva. Questa tecnologia è ancora troppo giovane per entrare nelle sale operatorie e, per il momento, rimane confinata ai laboratori di ricerca ma ormai sono tanti i ricercatori concordi sul fatto che essa guiderà le scelte in fatto di medicina rigenerativa per i prossimi anni.
Tuttavia, sulla strada per il successo della stampa 3D di organi – anzi di mini-organi, viste le loro dimensioni ridotte – ci sono ancora alcuni ostacoli da superare. Uno di questi è la difficoltà di portare ossigeno e nutrienti alle cellule che compongono i tessuti. È fondamentale riuscire a ricreare una rete di vasi capace di imitare quella naturalmente presente negli organismi e che permette l’afflusso di sangue e fluidi vitali ai diversi organi. L’angiogenesi, cioè la formazione di nuovi vasi sanguigni, è, infatti, un processo fondamentale per l’organismo, sia in condizioni fisiologiche che patologiche (basta pensare al tumore).
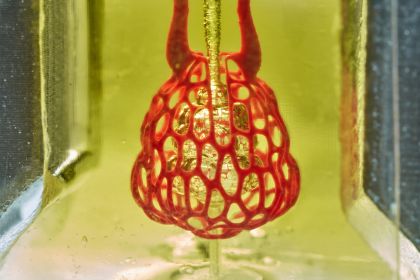
Tuttavia, grazie al lavoro dei bioingegneri della Rice University e dell’Università di Washington e dei ricercatori della Duke University, della Rowan University e della Nervous System - una società di progettazione con sede in Massachusetts - questo delicato passaggio sarà presto superato. I risultati della loro ricerca sono stati così sorprendenti da meritare la copertina del numero di inizio maggio della prestigiosa rivista Science. I ricercatori sono stati in grado di ricreare, ricorrendo a uno speciale hydrogel, un rudimentale modello di polmone costituito da una sorta di sacco d’aria nel quale le vie respiratorie forniscono ossigeno ai vasi sanguigni circostanti.
“Uno dei maggiori ostacoli alla produzione di sostituti del tessuto funzionale è la nostra incapacità di stampare la complessa vascolarizzazione in grado di fornire nutrienti ai tessuti densamente popolati” – afferma il dott. Jordan Miller, professore di bioingegneria presso la Rice’s Brown School of Engineering – “Inoltre, i nostri organi sono costituiti da reti vascolari indipendenti - come le vie aeree e i vasi sanguigni del polmone o i dotti biliari e i vasi sanguigni nel fegato. Queste reti interpenetranti sono fisicamente e biochimicamente invischiate, e la loro architettura stessa è intimamente legata al tessuto. La nostra è la prima tecnologia di bioprinting che affronta la sfida della multivascolarizzazione in modo diretto e completo”. Nel concreto, la tecnica descritta da Miller e dagli altri ricercatori prende il nome di “Apparato Stereolitografico per l’Ingegneria Tissutale” (StereoLithography Apparatus for Tissue Engineering, SLATE) e consiste in un delicato procedimento per la creazione di singoli strati di hydrogel che vengono stampati uno alla volta a partire da una soluzione liquida iniziale e diventano solidi una volta esposti a una luce blu proveniente dal basso. Gli strati hanno spessore infinitesimale e vengono sollevati uno ad uno da un braccio robotico per consentire la creazione dello strato successivo. Grazie all’aggiunta di speciali coloranti in grado di assorbire meglio la luce blu è stato possibile ottenere strati ancora più sottili, ma abbastanza robusti da poter tollerare il circolo di sangue e il flusso d’aria usato per simulare la respirazione umana, composti da materiali biocompatibili e in grado di riproporre la fine architettura interna di un organo complesso come il polmone. I ricercatori hanno eseguito immediatamente alcuni test osservando che nel modello da loro creato il passaggio di ossigeno si avvicinava notevolmente agli scambi di gas che si osservano negli alveoli polmonari.
La capacità di fabbricare strutture multivascolarizzate con materiali liquidi biocompatibili si configura come una modalità unica per produrre una stampa 3D di organi sostitutivi complessi, ribaltando completamente il settore dell’ingegneria tissutale. E, dal momento che solo chi osa può sperare di conseguire un risultato, Miller e la sua squadra hanno continuato il loro lavoro usando la tecnica SLATE per realizzare dei costrutti biostampati a base di cellule epatiche di topo. “Il fegato è particolarmente interessante perché svolge una vasta gamma di funzioni, probabilmente seconda solo al cervello” – spiega la dott.ssa Kelly R. Stevens, professoressa di bioingegneria e patologia presso l’Università di Washington e ricercatrice presso il Medicine Institute per Stem Cell and Regenerative Medicine – “Il livello di complessità anatomico e fisiologico del fegato è tale che, al momento quando esso risulti danneggiato, non esiste alcuna terapia in grado di sostituirne tutte le funzioni. Gli organi umani biostampati potrebbero un giorno fornire tale terapia”. I ricercatori hanno stampato in 3D i tessuti dotati di una fine compartimentazione per accogliere la rete vascolare su cui sono stati innestati gli hydrogel caricati con le cellule epatiche primarie. Questo costrutto è stato impiantato in topi con lesioni epatiche croniche e, a 14 giorni dall’impianto, le cellule sono sopravvissute e si sono rivelate funzionali.
“Con l’aggiunta della struttura multivascolare e intravascolare, stiamo introducendo un ampio set di libertà di design per l’ingegneria del tessuto vivente” – conclude Miller –“Ora abbiamo modo di costruire molte delle strutture complesse che si trovano nel corpo”. E le sue parole costituiscono un’infusione di speranza per le centinaia di migliaia di pazienti che nel mondo sono in attesa di un trapianto e anche per tutti coloro che sono già stati sottoposti a trapianto e stanno affrontando l’ardua sfida della terapia con farmaci immunosoppressori per evitare il rigetto.