RNA therapies: cosa sono e a cosa servono?
L’RNA - e, in particolare, l’RNA messaggero - sta vivendo il suo momento d’oro e il settore dei farmaci e vaccini basati su questa molecola sta letteralmente esplodendo. Nonostante la ricerca in questo campo sia iniziata almeno 30 anni fa, prima della pandemia COVID-19 il settore delle cosiddette “RNA therapies” non era ancora così conosciuto.
L’mRNA, GLI OLIGONUCLEOTIDI ANTISENSO E LA MEDICINA PERSONALIZZATA
L’mRNA è fondamentale per la nostra sopravvivenza perché è la molecola addetta a veicolare le istruzioni contenute nel genoma per far si che siano trasformate nel prodotto finale funzionante: le proteine. Utilizzando RNA sintetici si potrebbero quindi trasmettere informazioni specifiche all’interno delle cellule senza andare a modificare le istruzioni del DNA: questa è l’idea su cui si basa l’utilizzo dell’mRNA a scopo terapeutico, con l’obiettivo è quello di trasformare le cellule in una “fabbrica” di farmaci su richiesta.
Le terapie che hanno come bersaglio l'RNA, “RNA targeted therapies” in gergo scientifico, sono per lo più strategie basate su corte molecole di RNA o di DNA – chiamate oligonucleotidi antisenso - che agiscono modulando l’espressione dell’RNA messaggero mediante il meccanismo di “RNA interference” (che porta alla degradazione dell’mRNA, silenziando il gene) o di regolazione dello “splicing” cioè del processo di maturazione dell’mRNA (in questo caso si ha una modulazione dell’espressione del gene o la produzione di una proteina leggermente diversa).
Sono tra le tecnologie più rilevanti in ambito biotecnologico: riuscire a modulare l’mRNA in maniera precisa ed efficace permette di regolare l’espressione del prodotto di un gene senza cambiare il codice genetico originario, differenziandosi così dalla terapia genica e dall’editing genomico che hanno l’obiettivo di correggere il difetto genetico agendo direttamente sul DNA. L’RNA è di grande interesse anche per lo studio di terapie personalizzate. Pur essendo terapie molto innovative, non rientrano nella definizione tecnica di Advanced Therapy Medicinal Product (ATMP), quindi non sono terapie avanzate.
I vantaggi delle terapie che hanno come bersaglio l’RNA sono la reversibilità, poiché non viene modificato direttamente il DNA; la specificità con cui agiscono le molecole “interfering” o “antisenso”; e la facilità con cui vengono disegnate e sintetizzate. Inoltre, agire sull’RNA aumenta in maniera considerevole il numero e la tipologia di target che possono essere bersagliati a scopi terapeutici. Infatti, è possibile disegnare molecole dirette contro sequenze di RNA che codificano per proteine strutturali o fattori di trascrizione, ma anche verso RNA non codificanti ma comunque coinvolti in processi fisiopatologici come i microRNA. Attualmente sono state sviluppate, o sono in via di sviluppo, terapie per malattie metaboliche, neuromuscolari e neurodegenerative, infettive, cardiovascolari e tumorali.
E POI CI SONO I VACCINI
A questo si aggiunge tutta la ricerca sui vaccini a RNA, ormai noti al grande pubblico perché protagonisti della strategia vaccinale per combattere SARS-CoV-2. La pandemia ha, infatti, dato la spinta allo sviluppo di nuove piattaforme di produzione di vaccini, di cui l'mRNA è l'esempio più ovvio, e a un dibattito sul modo più efficace per produrre rapidamente vaccini protettivi di massa in caso di emergenze sanitarie.
I vaccini a RNA sono composti da un filamento sintetico di RNA messaggero racchiuso in una nanoparticella lipidica che ha il compito di trasportarlo all’interno delle nostre cellule: non contenendo le informazioni per la produzione del virus completo, il vaccino non può causare l’infezione vera e propria, ma la proteina prodotta dalle cellule è in grado di attivare il sistema immunitario umano. Anche se sviluppata per il COVID-19, questa strategia viene oggi studiata per lo sviluppo di vaccini per diverse altre malattie.
Al CIBIO di Trento si punta sul meccanismo di interferenza a RNA per contrastare patologie come la demenza fronto-temporale. Ne parliamo con la prof.ssa Michela Denti, coordinatrice della ricerca
Quando viene illustrato il dogma della biologia molecolare, con il passaggio dell’informazione genetica dagli acidi nucleici alle proteine, a guadagnarsi il ruolo dell’attore protagonista è sempre il DNA. In maniera analoga quando si discute di terapia genica o di editing genomico, il primo pensiero corre subito alle modifiche del DNA. Tutto questo a discapito dell’RNA, molecola di indiscusso valore che negli ultimi due decenni ha raggiunto una grande notorietà grazie anche allo sviluppo di un nuovo settore terapeutico basato sul meccanismo di interferenza a RNA. Le sue applicazioni cliniche stanno conquistando l’interesse di vari gruppi di ricerca, come quello coordinato dalla prof.ssa Michela Denti, del CIBIO di Trento, che da più di dieci anni si occupa di malattie neurodegenerative.
- Di: Enrico Orzes
Sviluppato un sistema per far entrare in maniera efficace i farmaci a RNA nelle cellule tumorali. Lo studio della Lund University, in Svezia, è stato pubblicato su Nature Communications.
C’è una nuova classe di farmaci che sta emergendo per la potenzialità di curare malattie dovute a difetti genetici. Sono le terapie che hanno come bersaglio l’RNA, due delle quali sono già state approvate: una per la cura della amiloidosi ereditaria da transtiretina (hATTR) e l’altra per la porfiria epatica acuta. Altre, come quella per la sclerosi laterale amiotrofica (SLA), sono tuttora in fase di ricerca preclinica. C’è però una sfida, ancora in parte da affrontare, che riguarda la consegna delle molecole di RNA nelle cellule dove hanno effetto. Per superare questo problema i ricercatori della Lund University in Svezia hanno sviluppato un sistema che si è rivelato efficace anche per far arrivare i farmaci a RNA nei tumori.
- Di: Cristina Tognaccini
Patisiran, la prima terapia basata su RNA interference approvata al mondo, è stata autorizzata da AIFA per il trattamento dei pazienti affetti da amiloidosi ereditaria da transtiretina (hATTR)
In questo periodo storico che stiamo vivendo tutto sembra essere dominato o aver a che fare con i virus. Per cui non sorprende che alle radici della scoperta che ha prima permesso di sviluppare una metodologia e poi di derivare da essa un farmaco contro l’amiloidosi hATTR ci siano comunque i virus. Si perché il meccanismo dell’RNA interference (o interferenza a RNA), su cui si basa il funzionamento di patisiran (con il nome commerciale Onpattro), il farmaco sviluppato da Alnylam Pharmaceuticals e approvato in Italia a inizio febbraio dall’AIFA per trattare i pazienti affetti da amiloidosi hATTR e con polineuropatia allo stadio 1 o 2, si sarebbe anticamente evoluto proprio per combattere le infezioni virali.
- Di: Enrico Orzes
Il silenziamento genico di SOD1 ha impedito l'insorgenza della SLA in topi presintomatici e ne ha bloccato la progressione in quelli che avevano già sviluppato i primi sintomi
Se il nostro DNA è un enorme “libretto delle istruzioni” per le cellule, che in ogni momento devono attingere da queste informazioni per svolgere le proprie funzioni, basterebbe saltare “un’istruzione” sbagliata per evitare l’insorgere di una malattia causata da un difetto genico. È quello che ha provato a fare un gruppo di ricerca internazionale, guidato da Martin Marsala dell’University of California San Diego School of Medicine, che ha utilizzato una corta molecola di RNA, per silenziare il gene disfunzionale SOD1, causa di una forma genetica di sclerosi laterale amiotrofica (SLA). I test – condotti per ora solo su modelli animali – hanno portato alla prevenzione e al blocco (a seconda dello stadio della malattia) della degenerazione dei neuroni motori.
- Di: Cristina Tognaccini
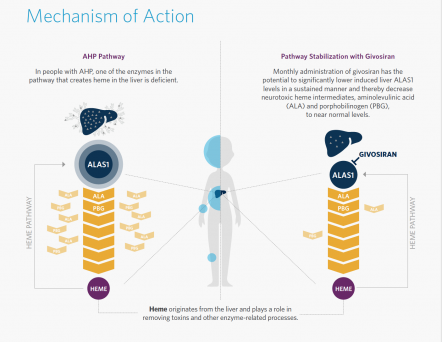
Il farmaco si basa su una strategia di RNA interference in grado di ridurre i livelli degli intermedi neurotossici dell’eme, causa degli attacchi della malattia.
Due anni e mezzo dopo aver ricevuto la designazione di terapia innovativa (Breakthrough Therapy) dalla Food and Drug Administration (FDA), givosiran, un farmaco basato sull’RNAi (RNA interference) sviluppato da Alnylam Pharmaceuticals, ha attenuto l’approvazione da parte dello stesso ente regolatorio statunitense. È indicato per il trattamento di pazienti adulti con porfiria epatica acuta, una malattia metabolica ereditaria, che porta all'accumulo di molecole tossiche dette porfirine, che si formano lungo la via di produzione dell’eme (complesso chimico che si trova nell’emoglobina e permette ai globuli rossi di legare l’ossigeno).
- Di: Cristina Tognaccini
La terapia antisenso porta il nome della bambina affetta dalla grave malattia genetica. Un grande successo scientifico ma le considerazioni da fare sono molte
Milasen: un farmaco studiato, progettato e prodotto al Boston Children’s Hospital per una sola bambina al mondo, la piccola Mila Makovec, da cui deriva il nome del farmaco. Il processo per arrivare al farmaco è stato pubblicato lo scorso 9 ottobre su The New England Journal of Medicine e la notizia ha fatto rapidamente il giro del mondo. Ma di cosa si tratta esattamente?
- Di: Rachele Mazzaracca